8月22日,《Cell Biomaterials》在线发表了太阳成城集团tyc234cc古天乐/数字医学工程全国重点实验室梁高林教授团队的最新研究成果,标题为《Intracellular nanofiber formation triggers nuclear fragmentation to enhance chemotherapeutic effect of camptothecin》。团队设计了一种新型的多肽-药物偶联物1-CPT-Nap,发展了一种通过癌细胞内酶控自组装的纳米纤维诱导细胞核碎裂、实现药物高效递送进核的策略,成功解决了癌症治疗过程中细胞核靶点抗癌药物递送效率低的难题。这是太阳成城集团tyc234cc古天乐首次在《Cell Biomaterials》上发表研究论文,标志着公司在生物与材料交叉研究领域取得重要突破。
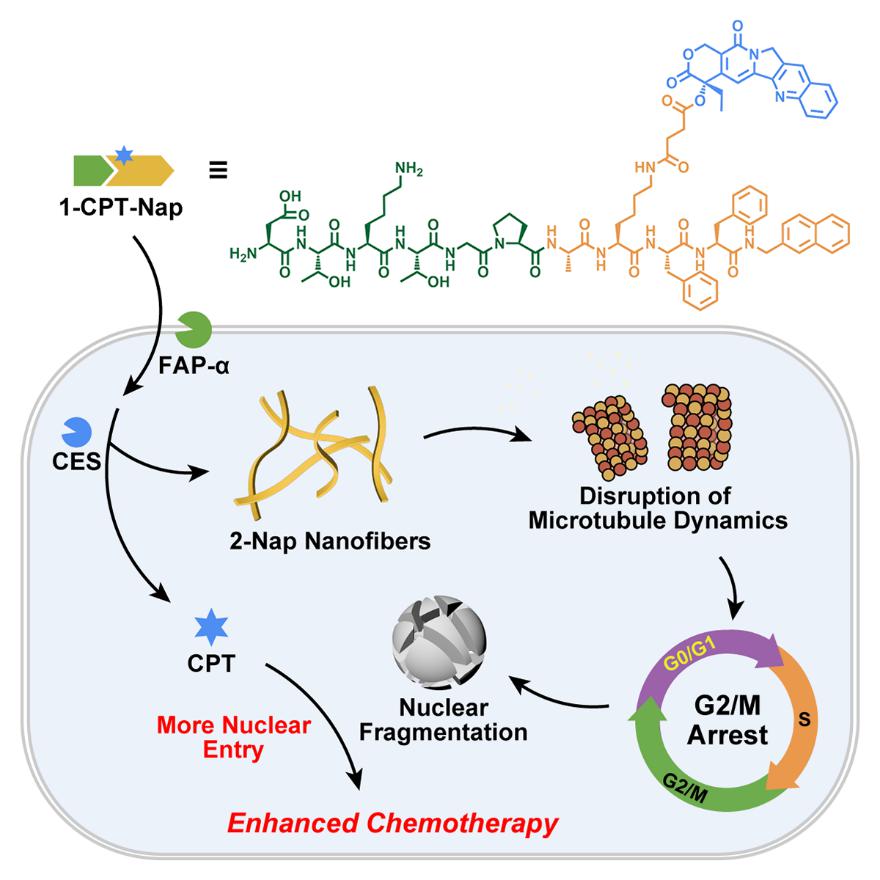
胰腺癌因其高致死率和高治疗难度成为医学界备受关注的重要疾病。尽管核靶点抗癌药物在胰腺癌治疗中展现出潜力,他们在临床应用中仍然面临巨大挑战:药物代谢周期短、容易被人体免疫系统快速清除;同时,细胞核的小孔径也大大限制了他们向核内的有效递送。针对这些关键科学问题,梁高林教授团队创新性地设计了多肽-药物偶联物1-CPT-Nap。偶联物由亲水四肽Asp-Thr-Lys-Thr、成纤维细胞活化蛋白α(FAP-α)作用多肽底物Gly-Pro-Ala、自组装多肽序列Phe-Phe-Nap以及核靶点化疗药物喜树碱(CPT)组成。偶联物通过上述多模块的协同作用实现抗癌药物的高效核递送。
如下图所示,在胰腺癌细胞中,1-CPT-Nap被高表达的FAP-α和羧酸酯酶(CES)依次激活,自组装成2-Nap纳米纤维并释放喜树碱。细胞内纳米纤维的形成扰乱了胞内微管动态,使细胞周期停滞在G2/M期,并进一步诱导细胞核碎裂。细胞核的碎裂显著增加了核靶点药物喜树碱的入核并发挥抗癌作用。体外实验数据表明,细胞内纳米纤维导致的细胞核碎裂使喜树碱的入核效率提升了1.8倍。动物实验结果表明,1-CPT-Nap对MIA PaCa-2胰腺癌的抑瘤效果是喜树碱的1.5倍。该研究巧妙利用肿瘤微环境的酶表达特征,将药物递送与细胞内的生化过程相结合,实现了“按需释放”和“核靶向递送”的双重突破,为核靶点药物的开发提供了新思路。团队将展开对1-CPT-Nap的后续深入研究、期待与药企共同开发并将其推进至临床转化,为胰腺癌的高效治疗提供新的候选药物。
太阳成城集团tyc234cc古天乐至善博士后程晓彤和博士生夏天天为该论文的共同第一作者。太阳成城集团tyc234cc古天乐首席教授/数字医学工程全国重点实验室副主任梁高林为论文的唯一通讯作者。该工作在国家重点研发计划、国家自然科学基金重点项目、江苏省前沿引领技术基础研究重大项目、国家资助博士后研究人员计划、中国博士后科学基金面上项目和江苏省研究生科研与实践创新计划等的资助下完成。
附文章链接:https://doi.org/10.1016/j.celbio.2025.100184
