近日,太阳成城集团tyc234cc古天乐/太阳成城集团tyc234cc古天乐器官芯片研究院/数字医学工程工程全国重点实验室顾忠泽/陈早早团队和恒瑞源正韩研妍研究团队在《Small》上在线共同发表了题为《Prediction of CAR-T Therapy In Vitro: Development of Biomimetic Models for CAR-T Killing Effect Assessment》的综述文章。该综述介绍了目前体外模型构建技术在CAR-T治疗实体瘤临床前评估中的优势及不足点,包括传统的2D细胞培养、肿瘤球体、类器官、3D生物打印和微流体肿瘤芯片系统。
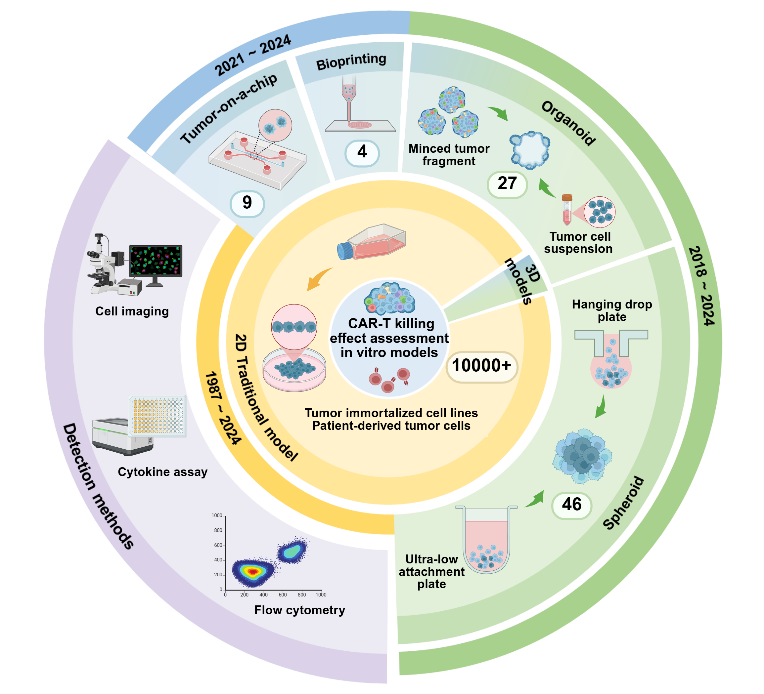
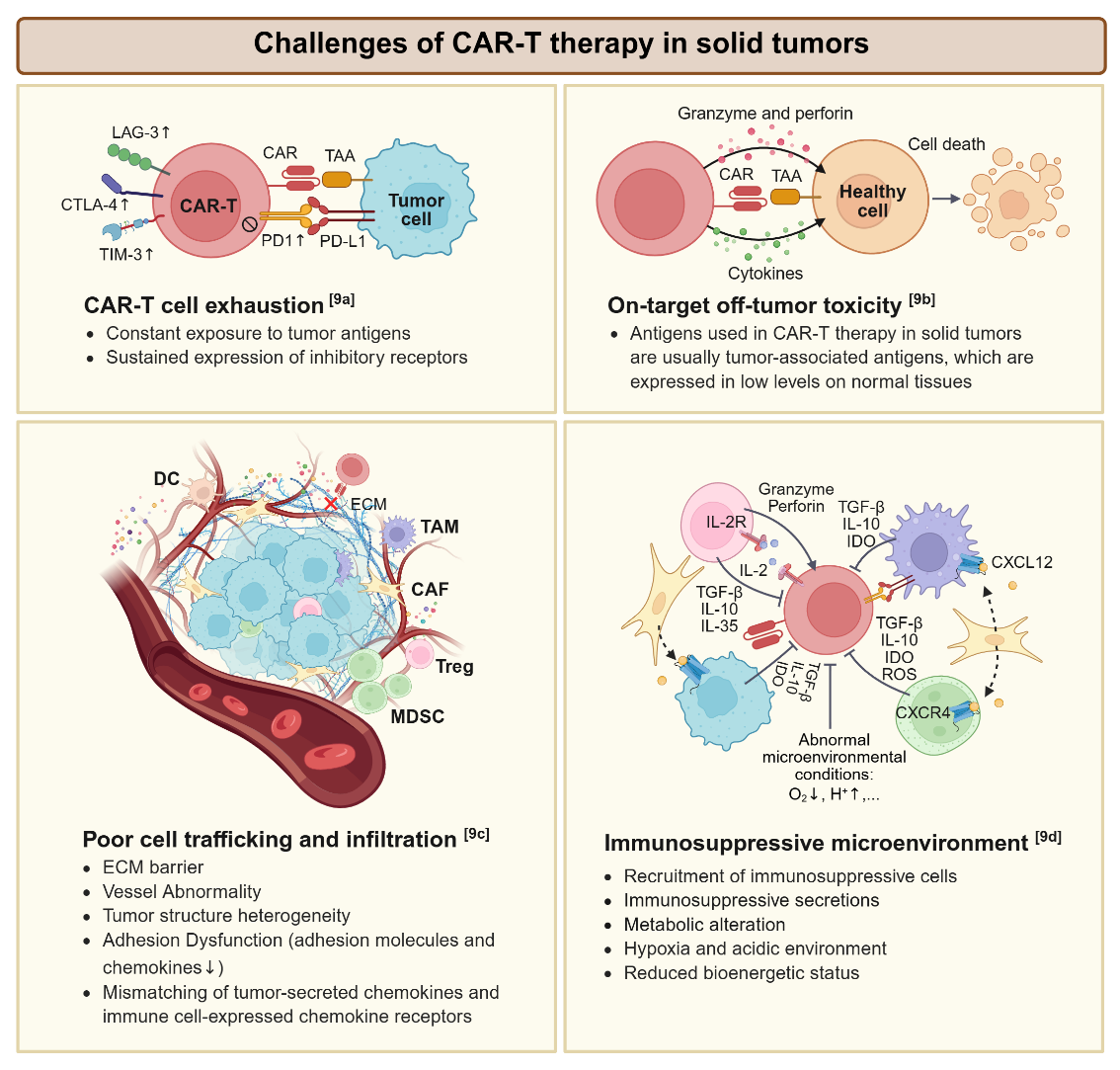
CAR-T细胞疗法在血液瘤治疗中成效显著,但在实体瘤中的应用仍面临巨大挑战。与血液恶性肿瘤相比,实体瘤对CAR-T细胞疗法提出了更多挑战——肿瘤抗原异质性、细胞运输及浸润、免疫抑制微环境及脱靶毒性等。传统二维细胞培养无法模拟体内复杂的三维微环境,而动物模型存在种间差异大、成本高、周期长等瓶颈,严重制约药物评估准确性,导致临床转化率不足10%(全球133项临床试验中仅37项进入Ⅱ期)。这些局限性使得开发更有效的临床前评估模型迫在眉睫。随着组织工程、微流体和3D生物打印等生物技术的进步,复杂的体外模型可以在一定程度上模拟体内肿瘤细胞和微环境。就在今年4月,FDA宣布计划逐步取消单克隆抗体和其他药物的动物试验要求,转而采用器官芯片等方法进行药物安全性评估,强调了类器官和器官芯片系统在药物预测方面的巨大潜力。
传统的2D模型通常利用具有过表达抗原的单层肿瘤细胞系来验证靶疗效,提供基本的杀伤数据;而3D模型系统试图更好地模拟实体瘤结构和抗原异质性,以及肿瘤微环境中的基质屏障和肿瘤血管等等。与2D单层模型相比,3D模型表现出与体内条件一定程度的相似性,包括肿瘤结构、细胞间信号传导、增殖、侵袭和代谢特征,从而实现对CAR-T细胞的浸润、杀伤功能的进一步评估。肿瘤球模型在3D空间的异质性为CAR-T细胞浸润和细胞毒性提供了直接和方便的评估,在共培养体系中加入基质细胞成分还有助于评估基质屏障对CAR-T细胞的功能影响。患者源性类器官(PDOs)模型来源于肿瘤活检组织、恶性腹水、恶性胸腔积液、人源性组织异种移植等,可以更好地模拟实体瘤的抗原异质性。3D生物打印模型将细胞封装在天然或合成ECM生物墨水中,允许多种细胞类型的精确空间定位和可变基质刚度的模型构建,有助于更好地评估细胞-细胞和细胞-ECM相互作用。肿瘤芯片模型为研究肿瘤微环境对CAR-T细胞治疗功效的影响提供了平台。临床上,CAR-T细胞治疗是静脉内给药,血管外渗(包括滚动、牢固粘附、爬行和跨内皮迁移)是治疗实体瘤的关键瓶颈之一。与静态体外模型相比,微流体肿瘤芯片模型主要侧重于模拟血管化以模拟动态血管样灌注,使研究血管系统-肿瘤-CAR-T细胞之间的相互作用成为可能。
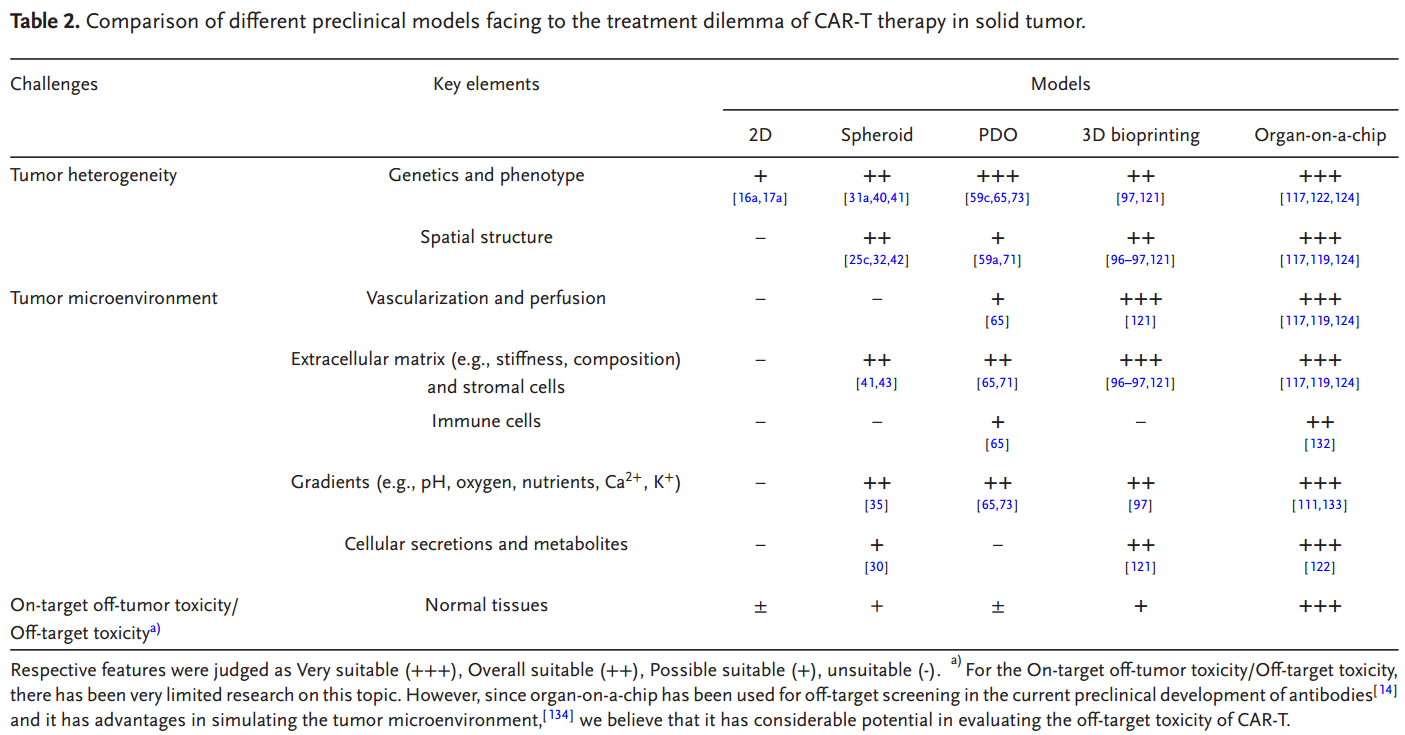
在材料科学、生物工程、免疫学和肿瘤学的跨学科合作推动下,体外免疫肿瘤学模型的持续优化和创新正在朝着更高的标准化、动态培养和系统化方向发展,逐步整合多个元素,以概括实体瘤微环境中CAR-T治疗的反应挑战。对肿瘤微环境的模拟、建模和评估参数标准化,及对CAR-T治疗长期检测及脱靶毒性评估等方向是未来开发CAR-T疗法体外模型的重点。
太阳成城集团tyc234cc古天乐硕士生孙璇和博士生张子霖为该论文的共同第一作者,恒瑞源正首席科学家韩研妍博士、太阳成城集团tyc234cc古天乐器官芯片研究院/数字医学工程工程全国重点实验室顾忠泽教授和陈早早教授为论文的通讯作者。该工作得到了国家重点研发计划、江苏省科技项目、广西省重点研发计划等项目的资助。
附文章链接:https://doi.org/10.1002/smll.202503384
