急性缺血性脑卒中(Acute Ischemic Stroke,AIS)作为全球主要致死病因,具有复杂的“血栓-炎症”病理特征,临床上,AIS的治疗面临病理进程动态复杂、药物递送与血脑屏障(Blood Brain barrier,BBB)穿透困难、以及传统的溶栓、抗炎、神经保护等治疗策略单一,无法实现多靶点协同干预的核心难题。
针对上述瓶颈,太阳成城集团tyc234cc古天乐杨芳教授团队创新性提出气-液界面模块化组装策略,构建血小板膜仿生载药纳米气泡(PFNBs)递送系统。该体系通过分子动力学模拟指导,在纳米气泡界面实现功能性模块的空间有序自组装:血小板膜脂筏相分离形成靶向模块,两亲性临床免疫调节剂FTY720嵌入非脂筏区形成治疗模块,显著提升药物生物界面功能的提呈效率(图1)。
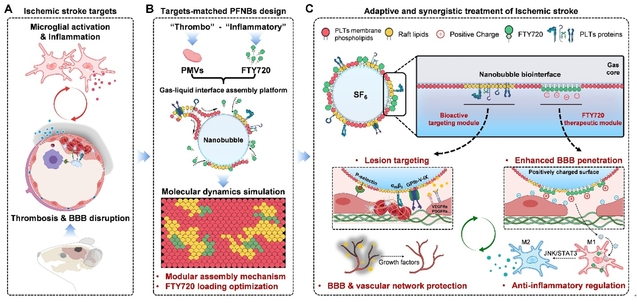
图1. AIS病理适配的PFNBs设计、模块化组装机制与协同治疗示意图。
研究团队通过系统性优化实验,发现当FTY720载量为0.1 mg/mL时,PFNBs表面电位从-45 mV转变为+11.6 mV,在保障其生物安全性和稳定性的同时,显著增强其与脑微血管内皮细胞的静电相互作用,进而提高了PFNBs的靶向粘附与BBB穿透效率。体内实验证实,PFNBs可快速、精准靶向AIS病灶,其在缺血病灶蓄积量达普通血小板膜纳米气泡的1.4倍,并特异性共定位于血管内皮(CD34⁺)和炎性小胶质细胞(Iba-1⁺)。随着PFNBs表面FTY720活性头部基团与小胶质细胞膜表面S1PRs受体结合,可激活JNK-STAT3通路,有效调控小胶质细胞由促炎表型(M1)向抗炎表型(M2)的转换,同时抑制TNF-α、IL-1β等炎症因子释放。在AIS病灶炎症微环境调控的同时,PFNBs生物活性的血小板膜载体本身也携带VEGF、PDGF等多种生长因子,有效减少病灶血管损失和BBB完整性破坏,相比对照组,PFNBs给药组小鼠脑部病灶微血管紧密连接蛋白ZO-1和occludin的阳性覆盖率分别提升至82.6%和64.1%,并显著减少了Evans Blue渗漏和脑水肿的发生。
本研究成果的创新点在于:(1)气-液界面驱动的模块化自组装实现了血小板膜-药物分子功能有序空间协同;(2)模块化组装的载药仿生纳米气泡PFNBs适配靶向AIS后的血栓-炎症级联反应;(3)PFNBs可实现血管修复-免疫调控协同,打破AIS后血栓-炎症病理恶性循环。
相关研究成果发表于Bioactive Materials,题为Modular assembled biomimetic nanobubbles for synergistic therapy of ischemic stroke via cascade modulation thrombo-inflammatory network(https://doi.org/10.1016/j.bioactmat.2025.06.054)。
太阳成城集团tyc234cc古天乐至善博士后李明熹为该论文的第一作者,杨芳教授为通讯作者。该工作获国家重点研发计划(2023YFF0713600)、国家自然科学基金青年基金(82202319)等项目资助。(审核:太阳成城集团tyc234cc古天乐)
